kolesterol düzeylerinden, lesitin kolesterol açiltransferaz
(LCAT) enziminin etkinli¤inden ve safra asitlerinden etkile-
nir. Karaci¤er hastal>¤> olup, LCAT aktivitesi bozulmufl olan
bireylerde eritrosit membran>nda biriken afl>r> kolesterol erit-
rosit morfolojisinin bozulmas>na (hedef hücre oluflumu) ve
bazen de hücrenin sa¤kal>m süresinin k>salmas>na yol açar.
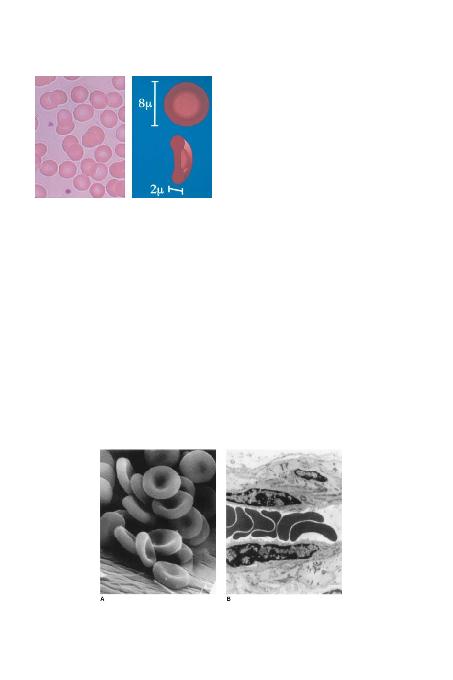
dana gelen bir retiküler protein a¤>na tutturulmufltur. fiekil 1-
3'de de görüldü¤ü gibi integral proteinler olan glikoforinler
(A-C) ve anyon de¤ifltirici olarak ifllev gören çomak 3 kafes
fleklindeki spektrin yap>s>ndan bafllay>p lipid tabakas>n>n için-
den geçerek hücre yüzeyine ulafl>rlar. Spektrin heterodimerle-
tay olarak etkileflerek çift katmanl> lipid membran>n>n alt>nda
alt>gen fleklinde bir kafes yap>s> meydana getirirler. Membra-
n>n dikey yap>s>nda meydana gelen bozukluklar (spektrin,
ankirin veya çomak 3 defekti veya lipid kayb>) sferosit oluflu-
muyla sonuçlan>r. Yatay spektrin yap>s>n>n hasar görmesi ise
eritrositlerin a¤>r biçimde parçalanmas>na ya da hafif eliptosi-
toza yol açar.
kan tipi belirlemesi aç>s>ndan birincil derecede önem tafl>yan
AB0 ve Rh kan grubu antijenleri ile birlikte bugüne kadar
300'den fazla eritrosit antijeni s>n>fland>r>lm>flt>r (Bkz. 38. Bö-
lüm). Minör kan grubu antijenlerine karfl> oluflan otoantikor-
lar retiküloendoleliyal hücreler taraf>ndan gerçeklefltirilen
eritrosit y>k>m>n>n artmas>na neden olabilirler.
grubuna sahip olan 4 polipeptid zincirinden meydana gelen
64,500 Da a¤>rl>¤>nda bir protein) deposu olarak görev yapar-
lar. Her hem grubu bir oksijen molekülü ba¤layabilir. He-
moglobinin solunumsal hareketi, yani oksijen tutulmas> ve
dokulara verilmesi, molekül yap>s>ndaki özgün bir de¤ifliklik
ile gerçekleflir (fiekil 1-4). Hemoglobin deoksihemoglobin
formundan oksihemoglobin formuna geçerken karbondioksit
(CO
mesini sa¤layacak flekilde aç>l>r. Ayr>ca, hem gruplar>ndan bi-
rine oksijen ba¤lanmas> di¤er gruplar>n oksijen affinitesini ar-
t>r>r. Bu etkileflim oksijen disosiasyon e¤risinin S fleklindeki
görünümünden sorumludur.
kas> alm>flt>r. Baz> bozukluklar molekülün hareketlerini engel-