genlerinden kaynakl> transkripsiyon faktörleri ve heparin
sülfat proteoglikanlar, lamininler, integrinler ve matriks
metalloproteinazlar (MMP9) gibi matriks molekülleri ürete-
ral tomurcu¤un büyümesi ve dallanmas>n>n inhibisyonu
veya stimülasyonuna kat>l>rlar (Davies ve ark., 1995; Men-
delsohn ve ark., 1999; Qiao ve ark., 1999; Pohl ve ark.,
2000; Davies, 2001; Qiao ve ark., 2001; Takemura ve ark.,
2002; Majumdar ve ark., 2003; Sakurai, 2003; Bush ve
ark., 2004; Chen ve ark., 2004; Basson ve ark., 2006). TGF-
ailesinin bir üyesi olan Aktivin A, üreterik tomurcu¤un
wolf kanal> yönünde büyümesinin endojen bir inhibitörü-
dür (Maeshima ve ark., 2006). Aktivin A GDNF taraf>ndan
uyar>lan üreteral tomurcuk oluflumunu inhibe eder ve buna
wolf kanal>ndaki hücre proliferasyonunun inhibisyonu,
PAX-2 üretiminin azalmas> ve PI3-kinaz ve MAP kinaz fos-
forilasyonunun azalmas> efllik eder. Her bir üreteral tomur-
cuk ucu metanefrik mezanflim komflulu¤unu uyarma kapa-
sitesi ile mezanflim-epitel dönüflümü (MET) ile nefron olu-
flumunu sa¤lar (Ekblom, 1989; Shah ve ark., 2004).
ken; apoptozisin ileti yolunu oluflturan kaspas inhibi-
törleri üreteral tomurcuk uzamas>na inhibe eder (Ara-
ki ve ark., 1999).
Gil ve ark., 1975; Alcaraz ve ark., 1991).
re-kanalizasyon iflleminde (Yerkes ve ark. 1998) ve
anormal üreteral tomurcuklanman>n inhibisyonunda et-
kindir (Oshima ve ark., 2001). ATR2 geni olmayan fare-
lerde çift toplay>c> sistem ile hidronefrotik üst pol parças>,
multikistik displastik böbrekler, megaüreterler ve üretero-
pelvik bileflke (UPJ) darl>¤> gibi çeflitli böbrek ve üreter
anomalileri bulunur. Anjiyotensin II tip 1 reseptörleri ek-
sik mutant farelerde renal pelvis geliflimi baflar>s>z ve üre-
teral peristaltik aktivite eksik olur (Miyazaki ve ark.,
1998). Anjiotensin II, anjiotensin II tip 1 reseptörleri üze-
rinden etki eder, ayr>ca üreterik tomurcuk hücre dallan-
mas>na yol açar, bu aflama epidemal büyüme faktörü
(EGF) reseptörünün fosforilasyonuna ba¤l>d>r (Iosipiv ve
Schroeder, 2003; Yosypiv ve ark., 2006).
molekülü gibi görünmektedir. Kalsinörin fonksiyonu kal-
d>r>lm>fl mutant farelerde, üriner sistemin geliflimindeki
düz kas ve mezanflimal hücre proliferasyonunda azalma
ile pyeloüreteral peristaltizm defekti ile sonuçlanan renal
pelvis ve üreter geliflim anomalisi belirlenmifltir (Chang ve
ark., 2004).
içi hem de hücre d>fl> iyonlar>n da¤>l>m>na ve hücre
membran>n>n bu iyonlara geçirgenli¤ine ba¤l>d>r
(Hodgkin, 1958). Üreteral düz kas>n elektriksel aktivitesi-
nin temelini oluflturan iyonik temeller daha tam olarak an-
lafl>lamam>fl olsa da di¤er uyar>labilir dokularla benzerlik-
ler göstermektedir.
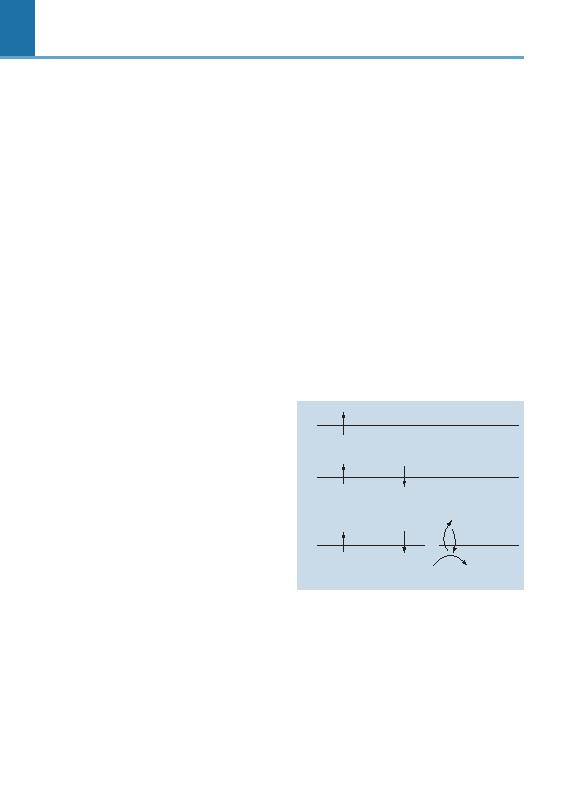
lenme faz>nda iken, hücre membran>nda iç ve d>fl ara-
siyeline, dinlenme membran potansiyeli (Resting
membrane potential RMP) ad> verilmektedir. RMP
esas olarak membran>n iç ve d>fl>ndaki K
belirlenir (Hendrickx ve ark., 1975). Dinlenme durumun-
da, hücre içindeki K
K
da hücre membran>n>n iç k>sm>nda negatif bir gradient
oluflturur (fiekil 59-1A). Bu oluflan negatif gradient ise K
k>fl>n> engelleyerek bir denge konumu sa¤lar. Sonuçta
hücre içinde, d>flar>s>na ra¤men daha yo¤un bir K
elektriksel aktivite bulunur.
90 mV olurdu beklenirdi. Bu Nernst formülünde de tahmin
edilebilen, K
¤ifliklikler. Potasyum daha yo¤un oldu¤u hücre içinden daha az
yo¤un oldu¤u hücre d>fl>na diffuze olur. Pozitif yüklü K
daha negatif yapar. B,
geçirgen olsayd> görülen elektrokimyasal de¤iflmeler. Na
¤i gibi hücre membran>n iç taraf>n> d>fla göre göre daha az negatif
olmas>n> sa¤lar. C, Hücre içinde, konsantrasyon ve elektrokimya-
sal gradiente karfl> Na
dura¤an RPM'nin sa¤lanmas>na yard>mc> olur. ECF ekstraselluler